category
在尽可能短的时间和尽可能低的成本下开发产品,拥有完善的项目流程是关键。它可以让你对项目进行控制,特别是在多项目环境中。一个公认的项目流程将有助于引入新员工或新项目团队成员,但不仅是新团队成员,而且医疗器械审核员也会感到宾得如家。
不幸的是,对于医疗器械产品开发项目过程中应该包含的不同步骤,没有统一的命名约定。但有些名字比其他名字更常见。它们经常从监管领域借用,其中一些概念已经在法规或标准中明确定义。
在一些情况下,处于一个受管制的行业也会导致非常关注管制过程的过程,这有时可能是不幸的,因为及时进入市场可能对管制遵从性同样重要。如果项目过程不支持项目管理和有效的产品开发,您可能会为此付出高昂的代价。幸运的是,可以将有效的产品开发和法规遵从性结合起来。
基于对多个项目模型及其过程的广泛研究,我整理了一些典型的常用名称和阶段,如下图所示。第一行表示我在处理医疗设备产品开发的项目流程时通常提倡的名称。下面的一行代表了一些最常用的名称(连同最上面的一行)。
请注意,产品维护阶段通常不被认为是项目过程的一部分,但它是产品生命周期的一部分。然而,它通常与产品开发有关。
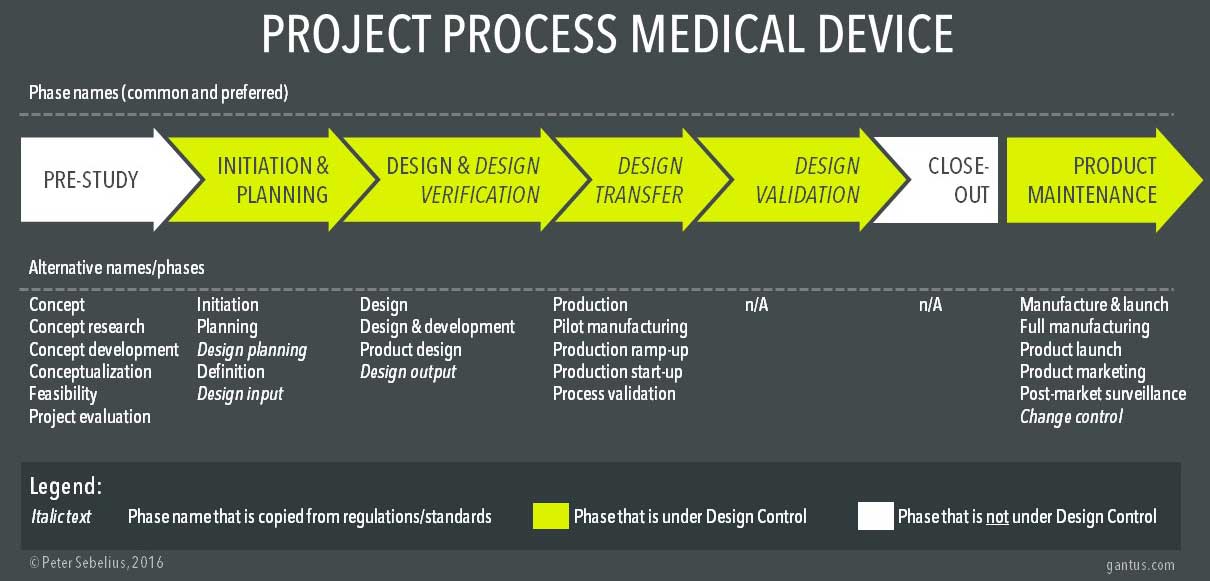
最上面的过程代表了一个更常见的项目过程,以及经常使用的替代名称。白色相位不在设计控制之下。斜体的名称表示直接取自监管概念的阶段名称。
典型的项目过程阶段的名称来自不同的领域,如项目管理(启动、计划)、法规和标准(设计规划、设计输入、设计输出、设计转移、设计验证)和制造(试生产、生产加速)。法规和标准对医疗器械行业的影响尤其大,无论好坏。有些项目过程示例几乎完全由设计控制术语和原则组成。
设计转移属于哪里?
设计转移是一个法规术语,定义为将设计结果转化为制造规范。设计转让可能是医疗设备制造商最难以就其应包括什么以及何时应发生达成一致的阶段。设计转移可视为包含与建立医疗设备生产有关的任务的工作包。这应该包括例如过程验证、寻找和评估供应商、过程设计、制造工具、编写装配说明和定义最终产品测试。但是这个阶段应该在什么时候发生与设计验证相关呢?有些人认为它应该在设计确认之后进行,但是应该记住,设计确认应该在产品或同等产品上进行,在此期间,制造商证明产品满足其预期用途和用户需求。如果没有经历和完成前面提到的领域,就很难(如果不是不可能的话)创造生产产品或同等产品。然而,您很可能会在设计确认之前或之后发现设计转换阶段。如果之后,设计转移通常是指一个坡道或扩大生产到大的数量。
有什么东西可以免于设计控制吗?
并非所有的项目过程都在设计控制之下,在这种情况下是前期研究和收尾阶段。可能有人会说,启动阶段也不在设计控制之下,但是设计控制肯定适用于规划阶段的末尾,此时设计和开发输入已经被定义。
阶段可以并行运行吗?
在医疗器械行业有一种普遍的误解,即在下一阶段开始之前需要完成一个阶段。但在标准或法规中并没有要求这样做。设计输入、设计输出、设计验证、设计转换和设计确认等概念与其说是阶段,不如说是原则或概念。FDA关于设计控制的指导文档(第5页)对如何使用并行工程而不是更传统的瀑布模型进行了很好的讨论。
原文:https://medicaldevicehq.com/perfect-project-process-medical-device-product-development/
本文:
讨论:请加入知识星球【首席架构师圈】或者小号【jiagoushi_pro】